Citometría de flujo
La citometría de flujo es una tecnología biofísica basada en la utilización de luz láser, empleada en el recuento y clasificación de células según sus características morfológicas, presencia de biomarcadores, y en la ingeniería de proteínas. En los citómetros de flujo, las células suspendidas en un fluido atraviesan un finísimo tubo transparente sobre el que incide un delgado rayo de luz láser, la luz transmitida y dispersada por el pasaje de las células a través del tubo se recoge por medio de unos dispositivos de detección, permitiendo hacer inferencias en cuanto a tamaño y complejidad de las células. También permite el análisis multiparamétrico simultáneo de otras características físicas y químicas, evaluando en promedio más de dos mil partículas por segundo.
La citometría de flujo es una técnica utilizada en forma rutinaria en muchos centros de salud para el diagnóstico y seguimiento de muchas enfermedades tales como las leucemias, granulomatosis crónica, y sida; sin embargo tiene muchísimas otras aplicaciones en investigación básica, práctica y ensayos clínicos. Una variante común de esta técnica es la separación física de partículas según sus propiedades, empleándose por ejemplo para purificar poblaciones de interés.
Historia
[editar]El primer citómetro de flujo basado en la medición de impedancia, es decir utilizando el principio Coulter, fue descrito en la patente de Estados Unidos N.º 2.656.508, expedida en 1953 a nombre de Wallace H. Coulter. Mack Fulwyler fue el inventor del precursor de los citómetros de flujo actuales, en particular del tipo separador de células.[1] El primer dispositivo de citometría de flujo basado en fluorescencia (ICP 11) fue desarrollado en 1968 por Wolfgang Göhde de la Universidad de Münster, y declarado en la patente de Alemania N.º 1815352 el 18 de diciembre de 1968.[2] Y comercializado por primera vez en los años 1968 y 1969 por la empresa alemana Partec encargada del desarrollo y producción a través de Phywe AG en Gotinga. En aquel tiempo los métodos de absorción electromagnética tenían el favor de la comunidad científica sobre los métodos fluorescentes.[3] Poco tiempo después comenzó el desarrollo comercial de los citómetros de flujo, incluyendo el citofluorógrafo (1971) de la empresa Bio/Physics Systems Inc. (más tarde Ortho Diagnostics), el PAS 8000 (1973) de la empresa Partec, y el primer dispositivo FACS de Becton Dickinson (1974), el ICP 22 (1975) de Partec/Phywe y el Epics de la Coulter Corporation en 1977/78.
Origen del nombre de la técnica
[editar]El nombre original de la citometría de flujo era "citofotometría de pulso" (en Alemán: Impulszytophotometrie), que fue el nombre publicado en la primera patente de aplicación práctica de la citometría de flujo fluorescente. Recién en la 5.ª Conferencia sobre Citometría Automatizada de la American Engineering Foundation realizada en Pensacola, Florida en 1976 -ocho años después de la presentación del primer citómetro de flujo fluorescente (1968)- se acordó utilizar el nombre de citometría de flujo, un término que rápidamente ganó popularidad.[4]
Principio
[editar]
Un rayo de luz monocromático, usualmente de luz láser, es dirigido hacia un finísimo chorro de líquido hidrodinámicamente enfocado. Se coloca una serie de detectores en el punto en el que el chorro de líquido atraviesa el rayo de luz. Uno se coloca en línea con el rayo de luz (a este detector se lo conoce como FSC, por Forward Scatter o detector de Dispersión Frontal), y varios angularmente a la trayectoria del rayo (a estos se los conoce como SSC, por Side Scatter, o detectores de Dispersión Lateral); además de uno o más detectores de fluorescencia. Cada una de las partículas suspendidas con un tamaño de entre 0,15 a 0,20 micrómetros que atraviesan el rayo de luz lo dispersan, y las sustancias químicas fluorescentes que se encuentran dentro o adheridas a la partículas son excitadas hasta emitir luz a una longitud de onda mayor que la de la fuente de luz. Esta combinación de luz dispersada y fluorescencia es recogida por los detectores, y por medio de un análisis en la fluctuación de la intensidad luminosa recogida por cada detector, es posible derivar varios tipos de información acerca de la estructura física y química de cada partícula individual.
El detector frontal o FSC brinda información acerca del volumen de la partícula, mientras que los detectores laterales o SSC brindan información acerca de la complejidad interna de la misma (por ejemplo la forma del núcleo celular, la cantidad y tipo de gránulos citoplasmáticos o la rugosidad de la membrana plasmática). Esto se debe a que los componentes internos de las células dispersan la luz. Algunos de los citómetros de flujo presentes en el mercado han eliminado la necesidad de un detector de fluorescencia y utilizan tan sólo la información de luz dispersada para las mediciones. Otros citómetros de flujo son capaces de generar gráficos de los datos obtenidos de la fluorescencia de las células, luz dispersada y luz transmitida.

Citómetros de flujo
[editar]Los citómetros de flujo modernos son capaces de analizar varios miles de partículas por segundo, en tiempo real, y pueden separar y aislar activamente partículas de acuerdo a propiedades específicas. Un citómetro de flujo es en cierta forma similar a un microscopio, salvo que, en vez de producir imágenes de las células, los citómetros de flujo ofrecen una cuantificación automática de una serie de parámetros con altísima calidad. Para analizar tejidos sólidos es posible preparar en primera instancia una suspensión de células.
Un citómetro de flujo tiene cinco componentes principales:
- La celda de flujo laminar, donde el líquido circulando en régimen de flujo laminar acarrea y pone en línea a las células de modo que pasen a través del rayo de luz de a una y en fila.
- Un sistema de medición, los más comúnmente utilizados son la medición de la impedancia o conductividad (principio Coulter) y los sistemas ópticos.
- Un sistema de iluminación formado ya sea por lámparas de alta luminosidad (de mercurio, xenón), láseres de alta potencia refrigerados por agua (de argón, de criptón, de tinturas), láseres de baja potencia refrigerados por aire (de argón λ 488 nm), láser rojo de helio-neón (λ 633 nm), verde de helio-neón, ultravioleta de helio-cadmio; láseres de diodo de baja potencia (azul, verde, rojo, violeta).
- Un detector y un conversor de señales ADC (análogo a digital), los cuales registran la señal producida (sea FSC, SSC, SFL) y la convierten en una señal eléctrica que puede ser procesada por un computador.
- Un sistema de amplificación, lineal o logarítmico.
- Un ordenador para el análisis de las señales.
El proceso de recolección de datos a partir de las muestras utilizando un citómetro de flujo es conocido como adquisición. La adquisición es mediada por un software presente en un ordenador físicamente conectado al citómetro de flujo. Este software es capaz de ajustar varios parámetros de la medición, tales como voltaje, compensación, etc. para cada una de las muestras analizadas, y además se encarga de asistir a la presentación inicial de la información de la muestra mientras se realiza la adquisición de los datos para asegurar que los parámetros han sido correctamente ajustados. Los primeros citómetros de flujo eran en su mayoría, dispositivos experimentales, sin embargo los avances técnicos desde su origen han permitido que ahora tengan una gran cantidad de aplicaciones tanto clínicas como de investigación. Debido a estos desarrollos, se ha producido un considerable mercado de instrumentos, software de análisis, y reactivos utilizados tanto en la adquisición como en el marcado fluorescente con anticuerpos.
Los instrumentos modernos en general poseen múltiples láseres y detectores. El récord actual para un instrumento comercial es de cuatro láseres y 18 detectores de fluorescencia. Al aumentar el número de láseres y detectores, es posible aumentar la cantidad de anticuerpos fluorescentes utilizados para el marcado, y se hace posible identificar con mayor precisión la población de interés a través de sus marcadores fenotípicos. Algunos instrumentos pueden incluso tomar fotografías digitales de cada célula, permitiendo analizar si la señal fluorescente se produce dentro o en la superficie de la célula.
Análisis de datos
[editar]Gating
[editar]
Los datos generados por los citómetros de flujo pueden ser dibujados en relación con una variable, en forma de histograma, o en gráficos de puntos (dot-plot) de dos dimensiones y dos o más variables, o incluso en gráficos tridimensionales. Las regiones delimitadas en estos gráficos pueden ser separadas secuencialmente, de acuerdo con la intensidad de la fluorescencia, para crear una serie de subgrupos llamados "gates" (portales). Existen protocolos específicos para hacer la separación en gates, proceso conocido como gating, tanto para propósitos clínicos como diagnósticos.
Los gráficos de citometría con frecuencia se hacen en función de escalas logarítmicas. Ya que los diferentes compuestos fluorescentes utilizados para hacer el marcado poseen espectros de emisión que con frecuencia se solapan,[5] las señales recogidas por los detectores deben ser compensadas tanto electrónica como computacionalmente. Los datos acumulados por los citómetros pueden ser analizados utilizando diferentes softwares, tales como por ejemplo WinMDI[6] (el único que es freeware), Flowjo, FCS Express, VenturiOne, CellQuest Pro, o Cytospec.[7] Una vez que se han recogido los datos, no se hace necesario que la computadora siga conectada al citómetro, razón por la cual la mayor parte de las veces el análisis de datos se hace en otro ordenador. Esto se hace especialmente necesario en instalaciones centrales donde la utilización de estas máquinas se encuentra bajo alta demanda.
Análisis computacional
[editar]Los progresos recientes en la identificación automática de poblaciones utilizando métodos computacionales ha ofrecido una alternativa a las estrategias tradicionales del gating. Los sistemas automatizados de identificación podrían, potencialmente, ayudar a encontrar poblaciones extremadamente pequeñas, raras, y ocultas. Los métodos automatizados más representativos incluyen al FLOCK[8] en Immunology Database and Analysis Portal (ImmPort),[9] FLAME[10] GenePattern y flowClust,[11][12][13] en Bioconductor. Los esfuerzos colaborativos han desembocado en un proyecto abierto llamado FlowCap (Flow Cytometry: Critical Assessment of Population Identification Methods,[14]) de manera de proveer una vía alternativa para comparar y evaluar los datos obtenidos por los métodos de agrupamiento en citometría de flujo, además de servir para establecer una guía para el uso y aplicación más apropiados para estos métodos.
Clasificación de células activadas por fluorescencia
[editar]
La técnica de clasificación de células activadas por fluorescencia FACS por sus siglas en inglés (Fluorescence-Activated Cell Sorting) es un tipo especializado de citometría de flujo. Esta técnica provee un método para la clasificación y selección de células provenientes de una mezcla de varias poblaciones en dos o más contenedores de a una célula por vez, según las características particulares de dispersión y fluorescencia de cada célula. Es un instrumento científico de gran utilidad ya que provee un método de grabación de datos provenientes de las señales de fluorescencia de cada célula que es a la vez rápido, objetivo y cuantitativo; además permite la separación física de aquellas células pertenecientes a una población de interés. El acrónimo FACS es una marca registrada perteneciente a Becton, Dickinson and Company.[15] Entre la gran mayoría de los investigadores que utilizan esta tecnología ya sea para la clasificación o el análisis, este término ha pasado a ser genérico en el uso común, al igual que xerox o kleenex. El clasificador de células fue inventado por Mack Fulwyler en 1965, utilizando originalmente el principio Coulter como método de recolección de datos, una técnica relativamente difícil y que ya casi no se utiliza en los instrumentos modernos. La técnica fue ampliada luego por Len Herzenberg, quien fue el responsable de acuñar el término FACS.[16] Herzenberg ganó el Premio Kioto en 2006 por su trabajo pionero en citometría de flujo.
La suspensión de células es arrastrada hacia el centro de una corriente de líquido estrecha, que fluye rápidamente. El flujo está dispuesto de manera que existe una gran separación entre células en relación con su diámetro. Un mecanismo de vibración ultrasónico provoca que la corriente de líquido conteniendo las células se rompa en pequeñas gotitas. El sistema se ajusta de modo que haya una baja probabilidad de que más de una célula quede contenida en cada gota. Justo antes de que la corriente se rompa en gotitas, el flujo pasa a través de una estación de medición de fluorescencia, donde se mide el carácter fluorescente de interés de cada célula. Un anillo capaz de adquirir una carga eléctrica se coloca justo en el punto donde la corriente se rompe en gotitas. Según la medición de la intensidad de fluorescencia recogida para cada célula, el sistema entrega una determinada carga eléctrica al anillo, como consecuencia las gotitas se cargan eléctricamente con un signo contrario al del anillo mientras se desprenden de la corriente de líquido. Las gotitas cargadas luego caen a través de un sistema de deflexión electrostática que desvía las gotas en los contenedores dependiendo de su carga. En algunos sistemas, la carga se aplica directamente a la corriente de líquido, y como resultado la gotita que se desprende retiene carga del mismo signo que la aplicada. Luego de que la gotita se desprende, el anillo recupera una carga neutra.
Marcadores
[editar]Marcadores fluorescentes
[editar]Se pueden utilizar un amplio rango de fluoróforos como etiquetas para el marcado fluorescente en citometría de flujo. Los fluoróforos se encuentran por lo general químicamente unidos a anticuerpos específicos capaces de reconocer una determinada molécula diana en la superficie o en el interior de la célula. Estas etiquetas fluorescentes también pueden adosarse químicamente a casi cualquier compuesto químico que presente una cierta afinidad por la membrana o alguna otra estructura celular. Cada fluoróforo posee un pico de excitación característico, y una longitud de onda de emisión también característica. Sin embargo los espectros de emisión de diferentes etiquetas con frecuencia se superponen, por consiguiente, la combinación de marcadores que pueden ser usados depende de la longitud de onda de la lámpara(s) o del láser(es) usados para excitar los fluorocromos y en los tipos de detectores que se encuentren disponibles.[17] El número máximo de marcadores fluorescentes distinguibles se cree que se encuentra entre 17 o 18, y este nivel de complejidad requiere un laborioso proceso de optimización para limitar los artefactos, así como complejos algoritmos de deconvolución para separar los espectros solapados.[18]
Marcadores fluorescentes de unión covalente: Isoticianato de fluoresceína, picoeritrina, rodamina, rojo texas, cianinas.[19]
Marcadores fluorescentes de unión no covalente: Hoechst, DAPI, Naranja de acridina, yoduro de propidio, rh12. Los marcadores fluorescentes son sensibles al medio ambiente.
Puntos cuánticos
[editar]A veces se utilizan puntos cuánticos en lugar de los tradicionales fluoróforos debido a que poseen un pico de emisión mucho más estrecho.
Marcado isotópico
[editar]Uno de los enfoques utilizados para soslayar el límite de marcas fluorescentes utilizables, es utilizar en su lugar isótopos de lantánidos adosados a los anticuerpos. Este método podría en teoría, permitir el uso de entre 40 y 60 marcadores perfectamente distinguibles, y ha sido demostrado hasta para 30 etiquetas distintas.[18] Las células son ionizadas por medio de un chorro de plasma permitiendo de esta manera identificar los isótopos asociados por medio de espectrometría de masas de tiempo de vuelo. Aunque este método permite el uso de un mayor número de etiquetas, de hecho posee un menor rendimiento que la citometría de flujo tradicional. Y además destruye las células analizadas, impidiendo de esta forma su recuperación para un proceso de selección.[18]
Parámetros usualmente medidos
[editar]Esta lista es realmente larga y se encuentra en continua expansión, por citar sólo algunos ejemplos:
- Se utiliza para confirmar el diagnóstico de leucemia linfática crónica
- Se utiliza para confirmar el diagnóstico de la enfermedad rara Hemoglobinuria Paroxística Nocturna (HPN)
- Volumen y complejidad morfológica de células
- Pigmentos biológicos tales como la clorofila o ficoreritrina
- Contenido total de ADN (análisis del ciclo celular, cinética celular, proliferación celular, ploidía, aneuploidía, endoreduplicación, etc.)
- Contenido total de ARN
- Variación en el número de copias de ADN (por medio de la tecnología Flow-FISH o BACs-on-Beads)
- Análisis cromosómico y separación (construcción de librerías, tinción de cromosomas, etc)
- Expresión y localización de proteínas
- Modificaciones proteicas, fosfoproteínas
- Presencia de productos transgénicos in vivo, particularmente demostración de la presencia de la Proteína verde fluorescente o proteínas fluorescentes relacionadas
- Antígenos celulares de superficie (Marcadores de diferenciación en clústeres - marcadores CD))
- Varios antígenos intracelulares tales como citoquinas, mediadores secundarios, etc.)
- Antígenos nucleares
- Actividad enzimática
- pH, calcio iónico intracelular, magnesio, potencial de membrana
- fluidez de membrana
- apoptosis (cuantificación según el grado de degradación del ADN, potencial de membrana mitocondrial, cambios en la permeabilidad, caspasas, etc
- Viabilidad celular
- Monitoreo de la electropermeabilización de células
- Estallido respiratorio
- Caracterización de la resistencia multidroga de células cancerosas
- Glutatión
- Varias combinaciones de ADN/antígenos de superficie
- Adherencia celular (por ejemplo adherencia entre células hospedadoras y patógenas)
Aplicaciones
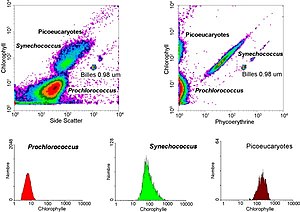
[editar]La tecnología de la citometría de flujo tiene aplicaciones en numerosos campos, incluyendo la biología molecular, inmunología, biología vegetal y marina. Tiene una amplia aplicación en medicina, (especialmente en trasplantes, hematología, inmunología tumoral, y quimioterapia, diagnóstico prenatal, genética y selección de esperma para una preselección de sexo). En biología marina se ha explotado las propiedades autofluorescentes del plancton fotosintético para caracterizar abundancia y estructura comunitaria. En ingeniería de proteínas, se utiliza la citometría de flujo en conjunción con técnicas de expresión en levaduras y expresión en bacterias, para identificar aquellas proteínas expresadas en la superficie celular que posean las características deseadas.
En una investigación, dentro del área genética se logró cuantificar el contenido de melanina mediante citometría de flujo al medir la propiedad de dispersión lateral de las células, lo que permitió realizar un ensayo genético de CRISPR-Cas9 que reportó 135 nuevos genes implicados en la síntesis de melanina.[20]
Véase también
[editar]Referencias
[editar]- ↑ Patente US Nº3380584, Mack Fulwyler; "Particle Separator", expedida el 01-06-1965
- ↑ Patente DE Nº1815352, Wolfgang Dittrich, Wolfgang Göhde; "Flow-through Chamber for Photometers to Measure and Count Particles in a Dispersion Medium, expedida el 18-12-1968
- ↑ Kamentsky in Proceedings of the 1968 Conference „Cytology Automation" (1970), edited by D. M. D. Evans.
- ↑ Sack et al., Ulrich. Zelluläre Diagnostik. Karger Publishers (2006).
- ↑ https://web.archive.org/web/20141020225338/http://pingu.salk.edu/flow/fluo.html
- ↑ «TSRI Cytometry Software Page». Archivado desde el original el 19 de noviembre de 1996. Consultado el 3 de septiembre de 2009.
- ↑ «PUCL Cytometry Software Page». Consultado el 7 de julio de 2011.
- ↑ Qian, Yu; Wei, Chungwen; Eun-Hyung Lee, F.; Campbell, John; Halliley, Jessica; Lee, Jamie A.; Cai, Jennifer; Kong, Y. Megan et al. (2010). «Elucidation of seventeen human peripheral blood B-cell subsets and quantification of the tetanus response using a density-based method for the automated identification of cell populations in multidimensional flow cytometry data». Cytometry Part B: Clinical Cytometry. 78B: S69. doi:10.1002/cyto.b.20554.
- ↑ «Immunology Database and Analysis Portal». Archivado desde el original el 26 de julio de 2011. Consultado el 3 de septiembre de 2009.
- ↑ «FLow analysis with Automated Multivariate Estimation (FLAME)». Archivado desde el original el 21 de agosto de 2009. Consultado el 3 de septiembre de 2009.
- ↑ «flowClust». Consultado el 3 de septiembre de 2009.
- ↑ http://www3.interscience.wiley.com/journal/117925662/abstract?CRETRY=1&SRETRY=0
- ↑ http://www.biomedcentral.com/1471-2105/10/145
- ↑ «FlowCAP - Flow Cytometry: Critical Assessment of Population Identification Methods». Consultado el 3 de septiembre de 2009.
- ↑ «FACS MultiSET System» (PDF). Becton Dickinson. Archivado desde el original el 29 de marzo de 2007. Consultado el 9 de febrero de 2007.
- ↑ Herzenberg, LA; Julius MH; Masuda T (1972). «Demonstration that antigen-binding cells are precursors of antibody-producing cells after purification with a fluorescence-activated cell sorter.». PNAS 69 (7): 1934-8. PMC 426835. PMID 4114858.
- ↑ Loken MR (1990). Immunofluorescence Techniques in Flow Cytometry and Sorting (2nd edición). Wiley. pp. 341-53.
- ↑ a b c Ornatsky, O.; Bandura, D.; Baranov, V.; Nitz, M.; Winnik, M. A.; Tanner, S. (2010). «Highly multiparametric analysis by máss cytometry». Journal of Immunological Methods 361 (1–2): 1-20. PMID 20655312. doi:10.1016/j.jim.2010.07.002.
- ↑ «Copia archivada». Archivado desde el original el 29 de octubre de 2013. Consultado el 24 de octubre de 2013.
- ↑ Bajpai, Vivek K.; Swigut, Tomek; Mohammed, Jaaved; Naqvi, Sahin; Arreola, Martin; Tycko, Josh; Kim, Tayne C.; Pritchard, Jonathan K. et al. (11 de agosto de 2023). «A genome-wide genetic screen uncovers determinants of human pigmentation». Science (New York, N.Y.) 381 (6658): eade6289. ISSN 1095-9203. PMID 37561850. doi:10.1126/science.ade6289. Consultado el 19 de enero de 2024.
Bibliografía
[editar]- Flow Cytometry First Principles by Alice Longobardi Givan. ISBN 0-471-38224-8
- Practical Flow Cytometry by Howard M. Shapiro. ISBN 0-471-41125-6
- Flow Cytometry for Biotechnology by Larry A. Sklar. ISBN 0-19-515234-4
- Handbook of Flow Cytometry Methods by J. Paul Robinson, et al. ISBN 0-471-59634-5
- Current Protocols in Cytometry, Wiley-Liss Pub. ISSN 1934-9297
- Flow Cytometry in Clinical Diagnosis, v4, (Carey, McCoy, and Keren, eds), ASCP Press, 2007. ISBN 0-89189-548-5
- Ormerod, M.G. (ed.) (2000) Flow Cytometry — A practical approach. 3rd edition. Oxford University Press, Oxford, UK. ISBN 0-19-963824-1
- Ormerod, M.G. (1999) Flow Cytometry. 2nd edition. BIOS Scientific Publishers, Oxford. ISBN 1-85996-107-X
- Flow Cytometry — A basic introduction. Michael G. Ormerod, 2008. ISBN 978-0-9559812-0-3
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre Citometría de flujo.
Wikimedia Commons alberga una categoría multimedia sobre Citometría de flujo.- Flow cytometry - How does it work? (Oregon State University)
- How a flow cytometer operates (MD Anderson Cancer Center)
- Learn About Flow Cytometry (Millipore)
- Powerpoint lectures on flow cytometry (Purdue University)
- Tutorials on fluorescence and flow cytometry (Invitrogen)
- Searchable database of fluorescent dyes Archivado el 18 de diciembre de 2014 en Wayback Machine. (Graz University of Technology)
- Table of fluorochromes (Salk Institute)
- Java Fluorescence Spectrum Viewer Archivado el 26 de enero de 2009 en Wayback Machine. (Becton, Dickinson and Company)
- MeSH: Flow+cytometry (en inglés)
- FICCS Archivado el 21 de noviembre de 2014 en Wayback Machine. - the Flow Informatics and Computation Cytometry Society
- History of Flow Cytometry by Bob Auer Archivado el 22 de marzo de 2012 en Wayback Machine. (hosted by Beckman Coulter)
- Flow Cytometry - A Basic Introduction (hosted by De Novo Software)
- Clinical Flow Wiki
- The History of the Cell Sorter Interviews from the Smithsonian Institution Archives
